![]() Acceso Libre |
Acceso Libre | ![]() Artículo Revisado por Pares
Artículo Revisado por Pares
Edgar Daniel Tenez Rivas – tenesguatemalensis@gmail.com
Escuela de Biología, Universidad de San Carlos de Guatemala
*Foto de Saltarin cabecirojo: Daniel Tenez 2008
| Cita: Tenez, D. (2017). Avifauna del Parque Nacional Sierra de Lacandón, Guatemala. Revista Yu’am 2 (3): 17-26. |
| Recibido: 16/6/2017 Aceptado: 8/8/2017 Publicado: 1/9/2017 |
El Parque Nacional Sierra del Lacandón, ubicado en la Reserva de la Biosfera Maya, es la segunda área protegida más grande de Guatemala. Es una zona montañosa con bosque húmedo subtropical en buen estado de conservación. Forma parte de una región que se ha propuesto como área de importancia internacional para la conservación de aves y constituye uno de los últimos sitios de distribución en el país de la guacamaya roja (Ara macao cyanoptera). En el parque se han realizado algunos estudios ornitológicos desde 1998, pero una lista completa de la avifauna no ha sido compilada. Se recopilaron datos de campo de un estudio base, registros bibliográficos y se revisó una base de datos en línea para elaborar un listado de las aves del parque y su zona de influencia en el río Usumacinta. Dentro del parque se han registrado 270 especies de aves, y al incluir otras especies complementarias se obtiene un listado compilado de 368 especies. Además, se presentan datos de diversidad de aves del sotobosque como referencia para comparar el estado de estas especies sensibles a cambios en el hábitat. Además, se evaluó la diferencia entre la diversidad de las comunidades de estas especies según el relieve del parque.
Introducción
El Parque Nacional Sierra del Lacandón (PNSL) es una región montañosa en el norte de Guatemala que forma parte de la zona núcleo de la Reserva de la Biosfera Maya (RBM), que junto a otras áreas protegidas de México y Belice comprenden la Selva Maya, que constituye el mayor bloque de bosque húmedo subtropical de Centroamérica. Además, el PNSL es el segundo parque nacional más grande del país y el 58% de su zonificación interna corresponde a la zona intangible donde el estado natural de los ecosistemas terrestres y acuáticos permanece relativamente bien conservado (CONAP, 2005).
La RBM se ha propuesto como un área de importancia internacional para la conservación de aves, denominada Maya-Lacandón. Esto debido a la presencia de especies mundialmente amenazadas, de distribución restringida y por sostener más del 1 % de poblaciones regionales de aves acuáticas congregacionales (Eisermann y Avendaño, 2007). El PNSL es uno de los últimos refugios en Guatemala para la guacamaya roja (Ara macao), especie en peligro de extinción local (CONAP, 2009). Asimismo, el PNSL presenta hábitats para aves especialistas del interior del bosque y dependientes del sotobosque de bosques primarios. Las aves del sotobosque son altamente vulnerables a alteraciones del hábitat, pues su riqueza y abundancia se ven drásticamente afectadas, principalmente en gremios como las seguidoras de hormigas (Hawes, Barlow, Gardner y Peres, 2008). Se estima que las poblaciones de aves insectívoras terrestres tardan hasta 60 años para recuperarse en bosques secundarios abandonados (Powell, Stouffer y Johnson, 2013).
A pesar de la importancia ornitológica del PNSL, no existía un listado actualizado de la avifauna. Por lo tanto, el objetivo del presente estudio fue elaborar un listado compilado con registros dentro del parque desde 1998 hasta la fecha, así como en su zona de influencia en el río Usumacinta. Además, se incluyen datos de tasas de captura y diversidad de aves del sotobosque como línea base para hacer comparaciones a lo largo del tiempo o entre áreas. Se muestreó el sotobosque de sitios prístinos ubicados en serranías y planadas, se evaluó la diferencia de la diversidad según el tipo de relieve y la época del año.
Metodología
Área de estudio
El PNSL se ubica en el departamento de Petén. Abarca 202,868 ha y 290 km de perímetro. Limita al oeste con el río Usumacinta, el más grande y caudaloso de Centroamérica, fronterizo con territorio mexicano. Su relieve es montañoso con una altitud máxima de 636 msnm, que corresponde al punto más alto de la RBM. Posee tres serranías o series de colinas cársticas, paralelas al río y separadas entre sí por planicies. La precipitación promedio anual es de 1,822 mm, con una época seca de enero a mayo y otra lluviosa de junio a diciembre. La temperatura media anual es de 26 °C. Existen otros ríos permanentes, como los arroyos Yaxchilán y Macabilero, lagunas, lagunetas y cenotes. Los suelos predominantes no son aptos para cultivos. El bosque latifoliado húmedo de colinas es el más representado de los nueve ecosistemas terrestres del parque; además, existen seis asociaciones vegetales en áreas inundables, serranías, cimas, valles y sabana. El 51% del PNSL presenta bosque mediano y alto (de 6 a 40 m) en buen estado de conservación (CONAP, 2005).
Listado de la avifauna
Se elaboró con datos de campo de un estudio base que abarcó 9 sitios y 14 muestreos, así como datos bibliográficos de otros estudios dentro del PNSL y en la zona de influencia. Además, se revisó la base de datos en línea de observaciones de aves eBird, para incluir registros válidos en la región (eBird, 2017; Sullivan et al., 2009). El estudio base se realizó en la época lluviosa, de junio a octubre de 1998 y en la época seca, de enero a abril de 1999. Se utilizaron los métodos de redes de niebla y puntos de conteo (Ralph et al., 1996), conteos en el dosel, conteos antes del amanecer (Whitacre, Jones y Sutter, 1992) y observaciones casuales. Los sitios muestredos fueron: Yaxchilán 1 y 2 (Y1, Y2), Macabilero (MC), El Limón (LM), San Francisco (SF), San Francisco guamil (SG), Los Pocitos (PC), Guayacán 1 y 2 (G1, G2) que se muestran en la Figura 1. Se muestrearon la zona núcleo o intangible y la zona de recuperación principalmente. Se incluyó bosque alto y mediano en serranías y planadas, bosque inundable y sabana. Posteriormente, se realizaron dos estudios de menor duración, en bosques asociados a cuerpos de agua y en regeneración (Morales, 2001) y en bosques maduros, potreros y lagunas del área de Guayacán (Asturias, 2013).
El área de influencia evaluada fue la región del río Usumacinta en el PNSL. Al otro lado del río, en territorio mexicano, se ubica El Monumento Natural Yaxchilán (MNY), cuya avifauna se estudió entre 1997 y 1999 (Puebla-Olivares, Rodríguez-Ayala, Hernández-Baños y Navarro, 2002). Se incluyeron registros recientes para esta región de especies accidentales, transitorias, visitantes irregulares y con poblaciones reproductivas locales (Fagan y Komar, 2016).
Aves del sotobosque
Se presentan los datos del estudio base con el método de redes neblineras para el análisis de la diversidad de las aves del sotobosque. Se utilizaron de 7 a 8 redes (12 m, 2.5 m, 36 mm) por sitio, colocadas en línea recta separadas entre sí por 12 m. Las redes estuvieron abiertas entre siete y ocho horas desde el amanecer, por tres días consecutivos. El esfuerzo de muestreo se midió según el número de redes por el total de horas por sitio y se expresó en horas red (hr), donde una red abierta durante una hora constituye una hora red. Debido a que el esfuerzo entre sitios fue diferente, se utilizó como tasa de captura el número de individuos capturados por cada 100 hr (Rougès y Blake, 2001).
La diversidad se midió por medio del número efectivo o equivalente de especies (D1), que es el número de especies igualmente comunes o con la misma abundancia dentro de una comunidad, el cual es un valor directamente comparable. (Jost y González-Oreja, 2012). Esta es una medida de diversidad verdadera, a diferencia del índice de entropía de Shannon (H’), que solamente mide aspectos relacionados pero no la diversidad misma. Se obtiene al trasformar dicho índice: D1 = exp(H’) y pondera todas las especies según sus frecuencias, sin sobrevalorar a las especies raras ni a las más comunes (Jost, 2006). Con esta medida se calcula el tamaño del efecto o la magnitud de la diferencia de la diversidad entre sitios, expresada en porcentajes (Moreno, Barragán, Pineda y Pavón, 2011). Los cálculos se realizaron con el programa SpadeR (Chao, Ma, Hsieh y Chiu, 2015), que también generó intervalos de confianza al 95 %, utilizados para la comparación estadística entre comunidades (Moreno et al., 2011).
Los análisis corresponden a cinco sitios muestreados en ambas épocas. En la serranía paralela a la ribera del río Usumacinta se ubicaron los sitios Y1 y MC a una elevación de 220 y 190 msnm respectivamente; Y2 y LM se ubicaron en una planicie a 120 y 110 msnm; mientras que SF se ubicó en otra serranía a 385 msnm. Estos sitios estaban dentro de la zona núcleo y presentaban bosque alto o mediano maduro.

Figura 1. Mapa de ubicación del Parque Nacional Sierra del Lacandón (PNSL) y de puntos de muestreo con redes neblineras según la zonificación interna del parque. Se incluye ubicación del Monumento Natural Yaxchilán (MNY) en territorio mexicano al otro lado del río Usumacinta. Sitios: Yaxchilán 1 y 2 (Y1, Y2), Macabilero (MC), El Limón (LM), San Francisco (SF), San Francisco guamil (SF), Los Pocitos (PC), Guayacán 1 y 2 (G1, G2).
Resultados y discusión
Avifauna
Dentro del PNSL se han registrado 270 especies de aves, que incluyen 212 residentes, 56 migratorias y dos con estado incierto. Además, cuatro especies se consideraron probables. En la zona de influencia se reportan 94 especies que potencialmente podrían registrarse en el PNSL. Todas estas especies se recopilaron en un listado de la avifauna del PNSL y sus alrededores que comprende 23 órdenes, 63 familias y 368 especies (Anexo 1).
Este listado compilado representa el 51% de las 724 especies de aves registradas para Guatemala (Eisermann y Avendaño, 2006), lo cual indica una alta riqueza de especies. Sin embargo, dentro del PNSL solamente se ha registrado el 37% de las especies del país, por lo que es necesario verificar las especies complementarias.
El estado de dos especies (Falco femoralis y Geothlypis tolmiei) se considera incierto, ya que su distribución no abarca el área del PNSL (Fagan y Komar, 2016). En el estudio base se reporta a F. femoralis como probable y fue confirmada posteriormente en la misma región dentro del PNSL (Asturias, 2013). Su distribución original abarca la zona vecina al PNSL en territorio mexicano y en Guatemala estaba considerada como probablemente presente (Eisermann y Avendaño, 2006; Howell y Webb, 1995). Sin embargo, recientemente se ha reportado como vagante en Petén y se sospecha su presencia para la región del PNSL (Fagan y Komar, 2016). La otra es una especie migratoria reportada en el PNSL (Morales, 2001) y en la zona de influencia, donde se registró según especímenes de museo (Puebla-Olivares et al., 2002).
La distribución original de otras especies incluye la región del PNSL (Howell y Webb, 1995) pero actualmente no abarca esta área, como Pachyramphus cinnamomeus que al parecer ha desaparecido de su rango de distribución en Guatemala (Fagan y Komar, 2016). Esta especie recientemente fue registrada en la zona de influencia del PNSL (eBird, 2017). Mientras que otras especies (Sturnella magna, Agelaius phoeniceus, Tyrannus savana, Cyanocompsa parellina, Pyrocephalus rubinus) no estaban distribuidas para esta región (Howell y Webb, 1995) y presentan una distribución actual que abarca al PNSL (Fagan y Komar, 2016).
Cuatro especies se incluyeron como probables y requieren verificación. Se sospecha que la especie Dactylortyx thoracicus pudiera estar presente en el PNSL y la distribución de Xiphocolaptes promeropirhynchus en Petén no abarca al PNSL. La especie Progne sinaloe solamente posee un reporte para el país en Petén, mientras que Podiceps nigricollis no se ha reportado en el norte de Guatemala (Fagan y Komar, 2016; Howell y Webb, 1995).
La mayoría de las especies reportadas en la zona de influencia, podrían ser detectadas en el PNSL debido a la cercanía y continuidad del ecosistema. Sin embargo, algunas especies reportadas en el MNY corresponden a especímenes de museo y no han sido detectadas nuevamente, como Icterus pectoralis colectada en 1974 o Coccyzus erythropthalmus, Glaucidium brasilianum y Melospiza lincolnii entre otras (Puebla-Olivares et al., 2002). O bien, la especie Gymnocichla nudiceps observada únicamente en 1996 y que representó una extensión muy al oeste de su rango de distribución conocido (Puebla-Olivares et al., 2002). En Guatemala esta especie no se encuentra reportada actualmente (Fagan y Komar, 2016). La especie Electron carinatum reportada para la región del río Usumacinta que abarca al PNSL (Miller y Miller, 1996) se encuentra posiblemente extinta para esta área (IUCN, 2017).
En el estudio base se reporta el posible avistamiento de dos especies de alto interés para la conservación por estar casi amenazadas (IUCN, 2017), pero debido a la carencia de evidencias no se tomaron en cuenta. Sin embargo, ambas están registradas en el MNY. En 1998 el águila arpía (Harpia harpyja) se observó en tres ocasiones en el MNY; este importante hallazgo se consideró un indicador del buen estado del bosque primario de la zona (Puebla-Olivares et al., 2002). En 2011 se obtuvo otro registro (eBird, 2017). En el PNSL se dio un posible avistamiento en la región de Yaxchilán en 1999. Para Guatemala existen tres reportes de esta especie entre 1990 y 2002 (Vargas et al., 2006), pero actualmente no se distribuye en el país (Fagan y Komar, 2016). La otra especie es el águila solitaria (Buteogallus solitarius) con un posible registro en El Limón en 1999. Su situación actual también es incierta para Guatemala (Fagan y Komar, 2016).
En el PNSL se registraron otras especies amenazadas a nivel mundial, Crax rubra y Agami agami consideradas vulnerables; cuatro especies residentes (Meleagris ocellata, Tinamus major, Spizaetus ornatus, Amazona farinosa) y tres migratorias (Hylocichla mustelina, Vermivora chrysoptera, Passerina ciris) se encuentran casi amenazadas (IUCN, 2017). La guacamaya roja (Ara macao) se encuentra en peligro de extinción local (CONAP, 2009). Mientras que dos especies (M. ocellata, Arremonops chloronotus) son endémicas de la Península de Yucatán (Eisermann y Avendaño, 2006).
El pavo ocelado (M. ocellata) fue reportado en el estudio base y en un estudio sobre fauna cinegética del PNSL (Soto, 2003). Se ha considerado probablemente extinto en la región oeste del PNSL (IUCN, 2017) y su distribución actual no abarca el área el parque, ya que solamente se sospecha su presencia en el noroeste de Petén (Fagan y Komar, 2016).
Aves del sotobosque
Se registraron 81 especies (Cuadro 1), de las cuales 24 se detectaron exclusivamente con redes neblineras; mientras que seis especies (Attila spadiceus, Automolus ochrolaemus, Pachysylvia decurtata, Lanio aurantius, Micrastur ruficollis, Pteroglossus torquatus) también se detectaron con los otros métodos (Anexo 1). En el sotobosque eventualmente se pueden capturar especies del dosel (Hawes et al., 2008), como los tucanes (P. torquatus) capturados en Y1. Sin embargo, con redes neblineras no es posible detectar todas las especies del sotobosque (Dunn y Ralph, 2004) y se requiere utilizar más métodos.
Se capturaron 902 individuos en 2326 hr. El 81 % de las capturas se obtuvo con 27 especies (33 %) que presentaron más de 10 individuos. Es decir, pocas especies fueron dominantes y la mayoría presentó pocos individuos. Este es un patrón observado en otros sotobosques tropicales (Machado y Fonseca, 2000). La especie Ceratopipra mentalis (Figura 2) fue la más abundantemente capturada, con 71 individuos (9% de las capturas), seguida por Platyrinchus cancrominus (54 = 6%) y por la especie migratoria Hylocichla mustelina (49 = 5%). En otros bosques tropicales C. mentalis también ha sido la más capturada y se sabe que realiza migraciones altitudinales según la disponibilidad de frutos (Blake y Loiselle, 1991). La mayor captura de esta especie fue en la época seca en LM, probablemente asociada a la abundancia de alimento; además, debido al relieve en el PNSL podrán ocurrir estos movimientos.
Cuadro 1. Especies, número de individuos y total de individuos por especie en orden decreciente, capturados en el Parque Nacional Sierra del Lacandón durante la época lluviosa de 1998 y seca de 1999. Sitios: Yaxchilán 1 y 2 (Y1, Y2), Macabilero (MC), El Limón (LM), San Francisco (SF), San Francisco guamil (SF), Los Pocitos (PC), Guayacán 1 y 2 (G1, G2)
| LLUVIOSA | |||||||
| ESPECIE | Y1 | MC | Y2 | LM | SF | G1 | G2 |
| Ceratopipra mentalis | 5 | 1 | 8 | 5 | 5 | 3 | 5 |
| Platyrinchus cancrominus | 9 | 3 | 3 | 1 | 4 | 3 | 8 |
| Hylocichla mustelina | 4 | ||||||
| Glyphorynchus spirurus | 2 | 1 | 12 | 4 | 2 | 2 | |
| Schiffornis veraepacis | 3 | 4 | 3 | 4 | 1 | 1 | 3 |
| Tunchiornis ochraceiceps | 1 | 2 | 2 | 5 | 2 | 2 | |
| Habia fuscicauda | 2 | 3 | 1 | 6 | 1 | 5 | 2 |
| Mionectes oleagineus | 2 | 4 | 1 | ||||
| Geothlypis formosa | 5 | 10 | 4 | ||||
| Dendrocincla anabatina | 4 | 2 | 3 | 8 | |||
| Myiobius sulphureipygius | 1 | 2 | 1 | 4 | 1 | ||
| Dendrocincla homochroa | 1 | 2 | 3 | 1 | 2 | 9 | 1 |
| Henicorhina leucosticta | 8 | 5 | |||||
| Xenops minutus | 1 | 8 | 1 | 3 | 2 | 1 | 2 |
| Basileuterus culicivorus | 1 | 1 | 2 | 2 | 4 | 3 | |
| Automolus ochrolaemus | 5 | 4 | 1 | 5 | |||
| Sittasomus griseicapillus | 5 | 1 | 1 | 1 | 2 | 1 | 3 |
| Catharus ustulatus | 2 | ||||||
| Seiurus aurocapilla | 1 | 7 | |||||
| Setophaga citrina | 1 | 2 | 5 | ||||
| Amazilia candida | 2 | 5 | |||||
| Xiphorhynchus flavigaster | 1 | 3 | 1 | ||||
| Mniotilta varia | 2 | 7 | |||||
| Sclerurus guatemalensis | 1 | 2 | 2 | 1 | 1 | ||
| Leptopogon amaurocephalus | 2 | 1 | 2 | ||||
| Dysithamnus mentalis | 2 | 2 | |||||
| Arremon aurantiirostris | 2 | 4 | |||||
| Onychorhynchus coronatus | 4 | 2 | 1 | ||||
| Contopus cinereus | 2 | 5 | |||||
| Setophaga magnolia | 1 | 3 | |||||
| Hylomanes momotula | 2 | 3 | |||||
| Phaethornis longirostris | 2 | 1 | |||||
| Formicarius analis | 3 | ||||||
| Euphonia hirundinacea | 1 | ||||||
| Myiopagis viridicata | |||||||
| Ramphocaenus melanurus | 1 | 1 | |||||
| Campylopterus curvipennis | 1 | 1 | 1 | ||||
| Cyanocompsa parellina | 1 | 2 | 2 | ||||
| Geotrygon montana | 2 | ||||||
| Picoides fumigatus | 1 | ||||||
| Chloroceryle aenea | 2 | 1 | 1 | ||||
| Rhynchocyclus brevirostris | 1 | ||||||
| Terenotriccus erythrurus | 1 | 2 | |||||
| Attila spadiceus | 1 | 1 | 1 | ||||
| Helmitheros vermivorum | 1 | 1 | |||||
| Pachysylvia decurtata | 1 | ||||||
| Turdus assimilis | 2 | ||||||
| Dendrocolaptes sanctithomae | 1 | ||||||
| Phaethornis striigularis | |||||||
| Amazilia tzacatl | 1 | 1 | |||||
| Eucometis penicillata | 1 | ||||||
| Florisuga mellivora | |||||||
| Habia rubica | 1 | 1 | |||||
| Pteroglossus torquatus | 3 | ||||||
| Parkesia noveboracensis | 3 | ||||||
| Tolmomyias sulphurescens | 2 | ||||||
| Arremonops chloronotus | 2 | ||||||
| Cercomacroides tyrannina | |||||||
| Cyanocompsa cyanoides | 1 | ||||||
| Dumetella carolinensis | |||||||
| Heliomaster longirostris | |||||||
| Malacoptila panamensis | 1 | 1 | |||||
| Manacus candei | |||||||
| Pheugopedius maculipectus | |||||||
| Uropsila leucogastra | 1 | ||||||
| Anthracothorax prevostii | 1 | ||||||
| Euphonia gouldi | 1 | ||||||
| Geothlypis trichas | |||||||
| Icteria virens | 1 | ||||||
| Lanio aurantius | 1 | ||||||
| Leptotila verreauxi | |||||||
| Micrastur ruficollis | |||||||
| Microrhopias quixensis | |||||||
| Myiarchus tuberculifer | 1 | ||||||
| Myiarchus tyrannulus | 1 | ||||||
| Passerina cyanea | |||||||
| Piranga rubra | |||||||
| Rhytipterna holerythra | |||||||
| Setophaga ruticilla | 1 | ||||||
| Sporophila corvina | 1 | ||||||
| Vermivora cyanoptera | |||||||
| SECA | ||||||||
| ESPECIE | Y1 | MC | Y2 | LM | SF | PC | SG | Total |
| Ceratopipra mentalis | 3 | 5 | 5 | 19 | 4 | 3 | 71 | |
| Platyrinchus cancrominus | 1 | 8 | 2 | 7 | 4 | 1 | 54 | |
| Hylocichla mustelina | 4 | 3 | 20 | 2 | 8 | 8 | 49 | |
| Glyphorynchus spirurus | 9 | 1 | 1 | 3 | 2 | 39 | ||
| Schiffornis veraepacis | 1 | 4 | 2 | 3 | 1 | 7 | 1 | 38 |
| Tunchiornis ochraceiceps | 2 | 7 | 4 | 4 | 3 | 3 | 37 | |
| Habia fuscicauda | 1 | 5 | 1 | 4 | 5 | 36 | ||
| Mionectes oleagineus | 3 | 5 | 3 | 8 | 4 | 4 | 34 | |
| Geothlypis formosa | 3 | 5 | 1 | 1 | 3 | 32 | ||
| Dendrocincla anabatina | 2 | 1 | 3 | 3 | 2 | 3 | 31 | |
| Myiobius sulphureipygius | 4 | 4 | 1 | 5 | 3 | 5 | 31 | |
| Dendrocincla homochroa | 1 | 4 | 4 | 2 | 0 | 30 | ||
| Henicorhina leucosticta | 3 | 2 | 6 | 1 | 2 | 1 | 28 | |
| Xenops minutus | 3 | 1 | 2 | 2 | 26 | |||
| Basileuterus culicivorus | 3 | 2 | 1 | 2 | 3 | 1 | 25 | |
| Automolus ochrolaemus | 2 | 2 | 1 | 1 | 21 | |||
| Sittasomus griseicapillus | 2 | 2 | 2 | 1 | 21 | |||
| Catharus ustulatus | 9 | 4 | 1 | 1 | 17 | |||
| Seiurus aurocapilla | 1 | 2 | 2 | 13 | ||||
| Setophaga citrina | 2 | 1 | 1 | 1 | 13 | |||
| Amazilia candida | 1 | 4 | 1 | 13 | ||||
| Xiphorhynchus flavigaster | 2 | 3 | 1 | 1 | 12 | |||
| Mniotilta varia | 1 | 2 | 12 | |||||
| Sclerurus guatemalensis | 1 | 1 | 3 | 12 | ||||
| Leptopogon amaurocephalus | 1 | 1 | 1 | 2 | 1 | 1 | 12 | |
| Dysithamnus mentalis | 1 | 3 | 3 | 11 | ||||
| Arremon aurantiirostris | 2 | 1 | 1 | 10 | ||||
| Onychorhynchus coronatus | 2 | 9 | ||||||
| Contopus cinereus | 1 | 8 | ||||||
| Setophaga magnolia | 1 | 3 | 8 | |||||
| Hylomanes momotula | 1 | 2 | 8 | |||||
| Phaethornis longirostris | 4 | 1 | 8 | |||||
| Formicarius analis | 1 | 2 | 1 | 7 | ||||
| Euphonia hirundinacea | 5 | 6 | ||||||
| Myiopagis viridicata | 5 | 1 | 6 | |||||
| Ramphocaenus melanurus | 2 | 1 | 1 | 6 | ||||
| Campylopterus curvipennis | 2 | 5 | ||||||
| Cyanocompsa parellina | 5 | |||||||
| Geotrygon montana | 1 | 2 | 5 | |||||
| Picoides fumigatus | 2 | 1 | 1 | 5 | ||||
| Chloroceryle aenea | 4 | |||||||
| Rhynchocyclus brevirostris | 2 | 1 | 4 | |||||
| Terenotriccus erythrurus | 1 | 4 | ||||||
| Attila spadiceus | 1 | 4 | ||||||
| Helmitheros vermivorum | 1 | 1 | 4 | |||||
| Pachysylvia decurtata | 2 | 1 | 4 | |||||
| Turdus assimilis | 1 | 1 | 4 | |||||
| Dendrocolaptes sanctithomae | 1 | 1 | 3 | |||||
| Phaethornis striigularis | 1 | 1 | 1 | 3 | ||||
| Amazilia tzacatl | 1 | 3 | ||||||
| Eucometis penicillata | 2 | 3 | ||||||
| Florisuga mellivora | 1 | 1 | 1 | 3 | ||||
| Habia rubica | 1 | 3 | ||||||
| Pteroglossus torquatus | 3 | |||||||
| Parkesia noveboracensis | 3 | |||||||
| Tolmomyias sulphurescens | 1 | 3 | ||||||
| Arremonops chloronotus | 2 | |||||||
| Cercomacroides tyrannina | 2 | 2 | ||||||
| Cyanocompsa cyanoides | 1 | 2 | ||||||
| Dumetella carolinensis | 2 | 2 | ||||||
| Heliomaster longirostris | 2 | 2 | ||||||
| Malacoptila panamensis | 2 | |||||||
| Manacus candei | 1 | 1 | 2 | |||||
| Pheugopedius maculipectus | 1 | 1 | 2 | |||||
| Uropsila leucogastra | 1 | |||||||
| Anthracothorax prevostii | 1 | |||||||
| Euphonia gouldi | 1 | |||||||
| Geothlypis trichas | 1 | 1 | ||||||
| Icteria virens | 1 | |||||||
| Lanio aurantius | 1 | |||||||
| Leptotila verreauxi | 1 | 1 | ||||||
| Micrastur ruficollis | 1 | 1 | ||||||
| Microrhopias quixensis | 1 | 1 | ||||||
| Myiarchus tuberculifer | 1 | |||||||
| Myiarchus tyrannulus | 1 | |||||||
| Passerina cyanea | 1 | 1 | ||||||
| Piranga rubra | 1 | 1 | ||||||
| Rhytipterna holerythra | 1 | 1 | ||||||
| Setophaga ruticilla | 1 | |||||||
| Sporophila corvina | 1 | |||||||
| Vermivora cyanoptera | 1 | 1 | ||||||
Fuente: datos de campo.

Figura 2. Fotografía de Ceratopipra mentalis la especie con mayor número total de capturas en el sotobosque del Parque Nacional Sierra del Lacandón durante la época lluviosa de 1998 y época seca de 1999. – Fuente: E. D. Tenez.
En la época lluviosa los mayores valores de tasas de captura y diversidad se observaron en G1 y G2 (Cuadro 2). Estos sitios se muestrearon cuando las especies migratorias ya estaban presentes, lo que incrementó sus valores. En la época seca estaban inundados y no fueron muestreados, se ubicaron en la región de Guayacán que presenta bosques inundables y sabana natural, así como presencia humana. Los valores más bajos se obtuvieron en la época seca en SF que era el sitio ubicado a mayor altitud.
Cuadro 2. Número de horas red (hr), de especies (S), de individuos (N), tasa de captura en 100 hr (TC), diversidad según el número efectivo de especies (D1) y valores totales registrados en el Parque Nacional Sierra del Lacandón durante la estación lluviosa de 1998 y seca de 1999. Sitios: Yaxchilán 1 y 2 (Y1, Y2), Macabilero (MC), El Limón (LM), San Francisco (SF), San Francisco guamil (SF), Los Pocitos (PC), Guayacán 1 y 2 (G1, G2)
| LLUVIOSA | |||||
| SITIO | hr | S | N | TC | D1 |
| Y1 | 188 | 20 | 47 | 25 | 15 |
| MC | 176 | 24 | 53 | 30 | 20 |
| Y2 | 161 | 24 | 70 | 43 | 17 |
| LM | 184 | 26 | 67 | 36 | 21 |
| SF | 192 | 19 | 39 | 20 | 16 |
| G1 | 176 | 31 | 75 | 39 | 22 |
| G2 | 168 | 28 | 84 | 50 | 23 |
| PC | |||||
| SG | |||||
| SECA | |||||
| SITIO | hr | S | N | TC | D1 |
| Y1 | 160 | 25 | 48 | 30 | 22 |
| MC | 154 | 36 | 100 | 65 | 28 |
| Y2 | 164 | 29 | 88 | 54 | 19 |
| LM | 154 | 37 | 102 | 66 | 24 |
| SF | 156 | 9 | 12 | 8 | 8 |
| G1 | |||||
| G2 | |||||
| PC | 166 | 25 | 62 | 37 | 19 |
| SG | 126 | 27 | 55 | 44 | 21 |
| TOTAL | |||||
| SITIO | hr | S | N | TC | D1 |
| Y1 | 348 | 34 | 95 | 25 | 26 |
| MC | 330 | 45 | 153 | 46 | 34 |
| Y2 | 325 | 36 | 158 | 49 | 22 |
| LM | 338 | 44 | 169 | 50 | 29 |
| SF | 348 | 26 | 51 | 15 | 21 |
| G1 | |||||
| G2 | |||||
| PC | |||||
| SG | |||||
Fuente: Datos de campo.
Al comparar los sitios muestreados en ambas épocas por medio de los intervalos de confianza al 95 % (Figura 3), no se observa diferencia en la diversidad entre sitios durante la época lluviosa. En la época seca SF presentó el menor valor y fue diferente, ya que solamente se capturaron 9 especies y 12 individuos durante los tres días de muestreo. Este bajo número probablemente se debió al viento durante el muestreo, que pudo afectar la actividad de las aves, así como la detección de las redes debido a hojas secas atrapadas. El método de redes de niebla presenta varios sesgos para evaluar la abundancia relativa; por ejemplo, las condiciones climáticas afectan la detectabilidad de las especies (Remsen y Good, 1996).
A excepción de SF que redujo su diversidad en un 50 % en la época seca, en los otros sitios no existe diferencia entre épocas. Sin embargo, se observa una tendencia de incremento en la diversidad en la época seca, seguramente asociada a la presencia de especies migratorias, entre otros factores. Según los datos totales, MC fue el sitio con la mayor diversidad seguido por LM y Y1 con los cuales no se observó diferencia. Estos sitios registraron respectivamente el 85 y 75 % de la diversidad registrada en MC. Respecto al sitio menos diverso, la diversidad de aves en MC fue 3.5 veces mayor que SF.
Se esperaba que los sitios ubicados en la planicie (LM y Y2) fueran diferentes a los de la serranía paralela al río (Y1 y MC); pero únicamente Y2 fue distinto a MC. Más bien, se observó que los sitios cercanos, independientemente del relieve, no difirieron entre sí (MC y LM; Y1 y Y2). Es decir, al parecer el relieve no tuvo un efecto lo suficientemente marcado; además, otros factores como la densidad del sotobosque, la intensidad de la pendiente, la variación en la ubicación de las redes o la dispersión de las aves podrían haber afectado. Estos cuatro sitios pertenecían a un bloque continúo de bosque alto o mediano en buen estado de conservación, es decir presentaban condiciones similares. En SF el tipo de bosque era el mismo, pero en una serranía más alta; estaba rodeado por áreas perturbadas y debido a la afectación por incendios forestales no fue posible muestrear otro sitio a esta altitud.
Según la comparación de varios disturbios, los incendios y el aislamiento de parches de bosque presentan los efectos más severos sobre las aves del sotobosque, ya que generan comunidades divergentes a las aves de bosques continuos con sotobosque conservado (Barlow, Peres, Henriques, Stouffer y Wunderle, 2006). Para evaluar el efecto final de los disturbios se deben utilizar medidas sensibles a cambios en la diversidad y que sean comparables (Jost y González-Oreja, 2012). Los resultados de estos sitios con bosque maduro pueden ser tomados como referencia o sitios control dentro del PNSL para evaluar otros bosques prístinos, o bien en regeneración.
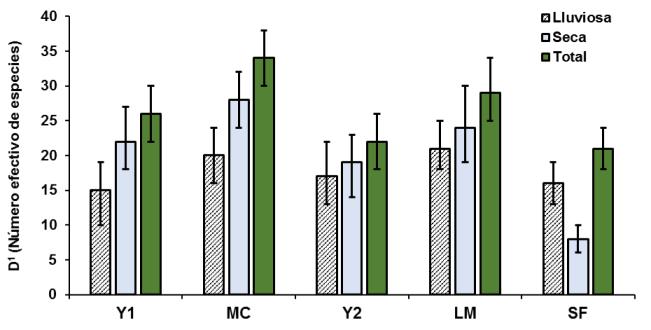
Figura 3. Diversidad según el número efectivo de especies (D1 ± IC: 95%) en los sitios Yaxchilán 1 y 2 (Y1, Y2), Macabilero (MC), El Limón (LM) y San Francisco (SF), que fueron muestreados tanto en la época lluviosa de 1998 como en la época seca de 1999 en el Parque Nacional Sierra del Lacandón. Se incluyen valores totales.
Implicaciones para la conservación y el manejo
La región donde se ubica el PNSL constituye el límite oeste de varias especies que podrían esperarse como casuales, entre ellas Pachyramphus polychopterus (Puebla-Olivares et al., 2002), que fue fotografiada recientemente en el MNY (eBird, 2017); es decir, se han registrado más especies. Es necesario realizar nuevos inventarios ornitológicos para detectar otras especies dentro del PNSL y confirmar las ya registradas; así como búsquedas intensivas para verificar las especies probables y las reportadas en la zona de influencia y otras áreas alrededor. La avifauna debe documentarse con evidencia fotográfica, colecciones científicas y registros bioacústicos.
El PNSL debería desarrollar un programa de monitoreo para evaluar tendencias poblacionales, en especial de las comunidades de aves del sotobosque. La especie más abundantemente capturada (C. mentalis) ha sido considerada indicadora del buen estado de conservación en bosques cercanos al PNSL (González-Valdivia et al., 2012). Se esperaría que los valores de diversidad de los sitios sin intervención humana se mantengan a lo largo del tiempo, por lo que se requieren muestreos comparativos. Estos valores también sirven de referencia para evaluar sitios perturbados. En ese sentido, se sugiere realizar estudios que determinen el efecto de los incendios forestales sobre las aves y el papel de las mismas en la regeneración natural de áreas afectadas en el PNSL.
Es necesario conocer el estado poblacional de las especies amenazadas y cinegéticas, como C. rubra reportada únicamente en el estudio base del PNSL. En el estudio del MNY solamente se reporta en la época seca con individuos dispersos (Puebla-Olivares et al., 2002). La guacamaya roja en el PNSL corresponde a la subespecie con distribución más al norte (A. m. cyanoptera), que ha experimentado aislamiento genético en dos poblaciones históricamente conectadas, una en Belice y la otra en la región del sur de México y el noroeste de Petén (Britt, García y Desmond, 2014). En esta región realiza movimientos estacionales que abarcan áreas tanto en territorio guatemalteco como mexicano, según un estudio de telemetría que incluyó guacamayas del PNSL (Morales, 2002). Esto implica tomar medidas de investigación, conservación y manejo a nivel local y regional para esta especie amenazada, que en Guatemala se ha estimado que existan entre 200 a 300 individuos silvestres (Eisermann y Avendaño, 2006). Dentro del PNSL se requiere conocer su situación poblacional y distribución, aspectos biológicos básicos y la caracterización de su hábitat; además de la protección y manejo de las zonas de anidación.
El PNSL posee importancia ornitológica por su alta riqueza y diversidad, así como por la presencia de especies clave para la conservación. Además, presenta áreas como el bloque continuo de bosque alto y mediano, importantes para aves dependientes del bosque y altamente sensibles a perturbaciones, o para especies que requieren grandes extensiones de bosque. O bien, áreas como la región de Guayacán con pastizales naturales donde se distribuyen especies exclusivas. La zona de influencia también presenta zonas prístinas, donde se ha destacado la ausencia de especies como Passer domesticus asociadas al ser humano (Puebla-Olivares et al., 2002); sin embargo, esta especie se ha reportado recientemente (Fagan y Komar 2016) por lo que requiere atención. Se debe apoyar la iniciativa mundial sobre áreas de importancia para la conservación de las aves (Eisermann y Avendaño, 2007) y establecer las acciones prioritarias específicas para el PNSL en términos de protección del hábitat natural, restauración y educación.
Agradecimientos
El estudio base formó parte de la Clasificación Ecológica del PNSL financiada TNC USAID. Agradezco especialmente a C. Marroquín y G. López por su asistencia en el campo. A M. V. Centeno, J. F. Hernández, R. Herrera y J. M. Mora por sus asesorías y revisiones. Por sus comentarios al presente estudio, agradezco a A. L. Grajeda y a los revisores anónimos y al comité editorial; a M. F. Asturias por su colaboración y a O. Machuca por apoyo técnico. A R. Leonardo y L. Masaya de Fundación Defensores de la Naturaleza por todo su apoyo.
Literatura citada
Asturias, M. F. (2013). Ensambles de aves en diferentes hábitats en la localidad de Guayacán en el Parque Nacional Sierra Del Lacandón en época migratoria, Guatemala, 2012 (Informe de Ejercicio Profesional Supervisado). Universidad de San Carlos de Guatemala, Guatemala.
Barlow, J., Peres, C. A., Henriques, L. M. P., Stouffer, P. C., & Wunderle, J. M. (2006). The responses of understory birds to forest fragmentation, logging and wildfires: an Amazonian synthesis. Biological Conservation, 128(2), 182-192.
Blake, J. G., & Loiselle. B. A. (1991). Variation in resource abundance affects capture rates of birds in three lowland habitats in Costa Rica. The Auk, 108, 114-130.
Britt, C. R., García, R., & Desmond, M. J. (2014). Nest survival of a long-lived psittacid: Scarlet Macaws (Ara macao cyanoptera) in the Maya Biosphere Reserve of Guatemala and Chiquibul Forest of Belize. The Condor, 116, 265-276.
Chao, A., Ma, K. H., Hsieh, T. C., & Chiu, C. H. (2015). Online Program SpadeR (Species-richness Prediction and Diversity Estimation in R). [Software de computación]. Recuperado de http://chao.stat.nthu.edu.tw/wordpress/software_download/
Consejo Nacional de Áreas Protegidas. (2005). Plan maestro 2006-2010 Parque Nacional Sierra del Lacandón (Serie co-ediciones técnicas No. 3 PNSL). Guatemala: Consejo Nacional de Áreas Protegidas.
Consejo Nacional de Áreas Protegidas. (2009). Listado de especies amenazadas de Guatemala -LEA- (2ª ed., Documento Técnico 67 02-2009). Guatemala: Consejo Nacional de Áreas Protegidas.
Dunn, E. H., & Ralph. C. J. (2004). Use of mist nets as a tool for bird population monitoring. Studies in Avian Biology, 29, 1-6.
eBird. (2017). eBird: Una base de datos en línea para la abundancia y distribución de las aves [Aplicación de internet]. Ithaca, NY: Cornell Laboratory of Ornithology. Recuperado de http://ebird.org
Eisermann, K., & Avendaño, C. (2006). Diversidad de aves en Guatemala, con una lista bibliográfica. En E. B. Cano (Ed.), Biodiversidad de Guatemala Volumen I (pp. 525-623). Guatemala: Universidad del Valle de Guatemala.
Eisermann, K., & Avendaño, C. (2007). Áreas propuestas para la designación como IBA (Área Importante para la Conservación de Aves) en Guatemala, con una priorización para la conservación adentro de las IBAs y una evaluación de las IBAs para aves migratorias Neárticas-Neotropicales (Informe Técnico). Guatemala: Sociedad Guatemalteca de Ornitología.
Fagan, J., & Komar, O. (2016). Peterson field guide to birds of Northern Central America. Nueva York, NY: Houghton Mifflin Harcourt.
González-Valdivia, N. A., Arriaga-Weiss, S. L., Ochoa-Gaona, S., Ferguson, B. G., Kampichler, C., & Pozo, C. (2012). Ensambles de aves diurnas a través de un gradiente de perturbación en un paisaje en el sureste de México. Acta Zoológica Mexicana, 28(2), 237-269.
Hawes, J., Barlow, J., Gardner, T. A., & Peres, C. A. (2008). The value of forest strips for understory birds in an Amazonian plantation landscape. Biological Conservation, 141(9), 2262-2278.
Howell, S. N. G., & Webb, S. (1995). A guide to the birds of Mexico and Northern Central America. Nueva York, NY: Oxford University Press.
International Union for Conservation of Nature. 2017. The IUCN Red List of Threatened Species (Version 2017-1). [Aplicación de internet]. Recuperado de http://www.iucnredlist.org
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363-375.
Jost, L., & González-Oreja, J. A. (2012). Midiendo la diversidad biológica: más allá del índice de Shannon. Acta zoológica Lilloana, 56(1-2), 3-14.
Machado, R. B., & Fonseca, G. A. B. (2000). The avifauna of Rio Doce Valley, Southeastern Brazil, a highly fragmented area. Biotropica, 32(4), 914-924.
Miller, B. W., & Miller, C. M. (1996). New information on the status and distribution of Keel-billed Motmot Electron carinatum in Belize, Central America. Cotinga, 6, 61-64.
Morales, R. (2001). Monitoreo de aves en diferentes microhábitats del Parque Nacional Sierra del Lacandón, La Libertad, Petén, 2000-2001 (Informe técnico). Guatemala: Fundación Defensores de la Naturaleza, Consejo Nacional de Áreas Protegidas.
Morales, R. (2002). Movimientos migratorios de la Guacamaya Roja Ara macao cyanoptera en los Parques Nacionales Sierra del Lacandón y Laguna del Tigre, Petén, Guatemala (Informe técnico). Guatemala: Fundación Defensores de la Naturaleza.
Moreno, C. E., Barragán, F., Pineda, E., & Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249-1261.
Powell, L. L., Stouffer, P. C., & Johnson, E. I. (2013). Recovery of understory bird movement across the interface of primary and secondary amazon rainforest. The Auk, 130(3), 459-468.
Puebla-Olivares, F., Rodríguez-Ayala, E., Hernández-Baños, B. E., & Navarro, A. G. (2002). Status and conservation of the avifauna of the Yaxchilán Natural Monument, Chiapas, México. Ornitología Neotropical, 13, 381-396.
Ralph, C. J., Geupel, G. R., Pyle, P., Martin, T. E., DeSante D. F., & Milá, B. (1996). Manual de métodos de campo para el monitoreo de aves terrestres (Gen. Tech. Rep. PSW-GTR-159). Albany, CA: Pacific Southwest Research Station, Forest Service, U.S. Department of Agriculture.
Remsen, J. V., & Good, D. A. (1996). Misuse of data from mist-net captures to assess relative abundance in bird populations. The Auk, 113(2), 381-398.
Rougès, M., & Blake, J. G. (2001). Tasas de captura y dietas de aves del sotobosque en el Parque Biológico Sierra de San Javier, Tucumán. El Hornero, 16(1), 7-15.
Soto, J. R. (2003). Impactos de cacería de una comunidad del Parque Nacional Sierra del Lacandón, La Libertad, Petén, sobre vertebrados mayores terrestres y arbóreos (Tesis de pregrado). Universidad de San Carlos de Guatemala, Guatemala.
Sullivan, B. L., Wood, C. L., Iliff, M. J., Bonney, R. E., Fink, D., & Kelling, S. (2009). eBird: a citizen-based bird observation network in the biological sciences. Biological Conservation, 142: 2282-2292.
Vargas, J. D. J., Whitacre, D., Mosquera, R., Albuquerque, J., Piana, R., Thiollay, J. M.,… Sanaiotti, T. (2006). Estado y distribución actual del águila arpía (Harpia harpyja) en Centro y Sur América. Ornitología Neotropical, 17, 39-55.
Whitacre, D. F., Jones, L. E., & Sutter, J. (1992). Censos de aves rapaces y de otras aves en el bosque tropical: mejoras hechas a la metodología. En D. F. Whitacre & R. K. Thorstrom (Eds.), Proyecto Maya: uso de aves rapaces y otra fauna como indicadores del medio ambiente, para el diseño y manejo de áreas protegidas y para fortalecer la capacidad local para la conservación en América Latina (Reporte de avance V, pp. 43-56). Boise, ID: The Peregrine Fund.
Anexo 1
Listado compilado de la avifauna registrada en el Parque Nacional Sierra del Lacandón (PNSL) y su zona de influencia en el río Usumacinta (AI). Se incluye el estado dentro del PNSL (E) y el tipo de registro.
| ORDEN/FAMILIA/Especie1 | PNSL2 | AI3 | E4 |
| TINAMIFORMES | |||
| TINAMIDAE | |||
| Tinamus major | P,A | R | |
| Crypturellus soui | C | R | |
| Crypturellus cinnamomeus | B2 | B3 | ?,r |
| Crypturellus boucardi | P,A | R | |
| ANSERIFORMES | |||
| ANATIDAE | |||
| Dendrocygna autumnalis | C | R | |
| Cairina moschata | B1,B2 | R | |
| Spatula discors | C | V | |
| Spatula clypeata | B4 | VI | |
| Aythya affinis | B4 | VI | |
| Nomonyx dominicus | B4 | Va | |
| GALLIFORMES | |||
| CRACIDAE | |||
| Ortalis vetula | P,A,D | R | |
| Penelope purpurascens | P,A,D | R | |
| Crax rubra | P,A | R | |
| ODONTOPHORIDAE | |||
| Dactylortyx thoracicus | ?C | ? | |
| Odontophorus guttatus | A | R | |
| PHASIANIDAE | |||
| Meleagris ocellata | C,B5 | ?,r | |
| PODICIPEDIFORMES | |||
| PODICIPEDIDAE | |||
| Tachybaptus dominicus | C | R | |
| Podilymbus podiceps | C | V | |
| Podiceps nigricollis | ?B2 | ? | |
| COLUMBIFORMES | |||
| COLUMBIDAE | |||
| Patagioenas cayannensis | B1 | R | |
| Patagioenas speciosa | P,A,D | R | |
| Patagioenas flavirostris | P | R | |
| Patagioenas nigrirostris | P,A,D | R | |
| Columbina minuta | B1 | R | |
| Columbina talpacoti | C | R | |
| Claravis pretiosa | C | R | |
| Geotrygon montana | P,R,A | R | |
| Leptotila verreauxi | P,R | R | |
| Leptotila cassinii | B3 | R | |
| Leptotila plumbeiceps | B1 | R | |
| Zenaida asiatica | I | R | |
| CUCULIFORMES | |||
| CUCULIDAE | |||
| Piaya cayana | P,D | R | |
| Coccyzus americanus | B3 | T | |
| Coccyzus erythropthalmus | B3 | ?,t | |
| Tapera naevia | P,A | R | |
| Dromococcyx phasianellus | C | R | |
| Crotophaga sulcirostris | C | R | |
| CAPRIMULGIFORMES | |||
| CAPRIMULGIDAE | |||
| Lurocalis semitorquatus | B3,B6 | ?,r | |
| Chordeiles acutipennis | C | V | |
| Nyctidromus albicollis | A | R | |
| NYCTIBIIFORMES | |||
| NYCTIBIIDAE | |||
| Nyctibius grandis | B7,I | R | |
| APODIFORMES | |||
| APODIDAE | |||
| Streptoprocne zonaris | D | R | |
| Chaetura vauxi | I | R | |
| Panyptila cayennensis | C | R | |
| TROCHILIDAE | |||
| Florisuga mellivora | R | R | |
| Phaethornis longirostris | P,R | R | |
| Phaethornis striigularis | R | R | |
| Heliothryx barroti | B3 | R | |
| Anthracothorax prevostii | R | R | |
| Lophornis helenae | B4 | RL | |
| Heliomaster longirostris | R | RL | |
| Archilochus colubris | B2 | V | |
| Chlorostilbon canivetii | B2 | R | |
| Phaeochroa cuvierii | C | R | |
| Campylopterus curvipennis | R | R | |
| Campylopterus hemileucurus | B4 | RL | |
| Eupherusa eximia | B3 | Va | |
| Amazilia candida | R | R | |
| Amazilia cyanocephala | B4 | RL | |
| Amazilia tzacatl | R | R | |
| Amazilia yucatanensis | B3 | R | |
| GRUIFORMES | |||
| RALLIDAE | |||
| Laterallus ruber | I | R | |
| Aramides albiventris | B1 | R | |
| Porphyrio martinicus | I | V | |
| Gallinula galeata | B1 | V | |
| Fulica americana | I | V | |
| HELIORNITHIDAE | |||
| Heliornis fulica | B1 | R | |
| ARAMIDAE | |||
| Aramus guarauna | B1,B2 | R | |
| CHARADRIIFORMES | |||
| CHARADRIIDAE | |||
| Charadrius collaris | I | V | |
| Charadrius vociferus | I | V | |
| JACANIDAE | |||
| Jacana spinosa | C | R | |
| SCOLOPACIDAE | |||
| Calidris himantopus | B4 | VI | |
| Calidris minutilla | I | V | |
| Calidris fuscicollis | B4 | T | |
| Actitis macularius | C | V | |
| Tringa solitaria | I | V | |
| Tringa melanoleuca | B3 | V | |
| Phalaropus tricolor | B4 | T | |
| LARIDAE | |||
| Leucophaeus atricilla | B3 | V | |
| CICONIIFORMES | |||
| CICONIIDAE | |||
| Mycteria americana | I | R | |
| SULIFORMES | |||
| PHALACROCORACIDAE | |||
| Phalacrocorax brasilianus | C | R | |
| ANHINGIDAE | |||
| Anhinga anhinga | C | R | |
| PELECANIFORMES | |||
| PELECANIDAE | |||
| Pelecanus erythrorhynchos | I | ? | |
| Pelecanus occidentalis | C | Va | |
| ARDEIDAE | |||
| Botaurus pinnatus | I | R | |
| Ixobrychus exilis | B1 | ?,r | |
| Tigrisoma mexicanum | C | R | |
| Ardea herodias | C | V | |
| Ardea alba | C | R | |
| Egretta thula | C | R | |
| Egretta caerulea | C | V | |
| Egretta tricolor | B2 | V | |
| Egretta rufescens | B4 | Va | |
| Bubulcus ibis | C | R | |
| Butorides virescens | C | R | |
| Agamia agami | A,C | ?,r | |
| Nycticorax nycticorax | B3 | T | |
| Nyctanassa violacea | I | V | |
| Cochlearius cochlearius | C | R | |
| THRESKIORNITHIDAE | |||
| Platalea ajaja | I | B4 | VI |
| CATHARTIFORMES | |||
| CATHARTIDAE | |||
| Coragyps atratus | P,D | R | |
| Cathartes aura | P,D | R | |
| Cathartes burrovianus | B2 | R | |
| Sarcoramphus papa | P,D | R | |
| ACCIPITRIFORMES | |||
| PANDIONIDAE | |||
| Pandion haliaetus | C | V,T | |
| ACCIPITRIDAE | |||
| Leptodon cayanensis | P,D | R | |
| Chondrohierax uncinatus | C | R | |
| Elanoides forficatus | D | VR | |
| Elanus leucurus | I | R | |
| Rostrhamus sociabilis | C | R | |
| Harpagus bidentatus | D | R | |
| Ictinia mississippiensis | I | T | |
| Ictinia plumbea | P,D | VR | |
| Busarellus nigricollis | I | R | |
| Circus hudsonius | C | ?,r | |
| Accipiter cooperii | I | V | |
| Accipiter bicolor | I | R | |
| Geranospiza caerulescens | D | V | |
| Buteogallus anthracinus | B2 | B3 | RL |
| Buteogallus urubitinga | P,A,D | R | |
| Buteogallus solitarius | ?C | B3 | ? |
| Rupornis magnirostris | P,D | R | |
| Pseudastur albicollis | P,D | R | |
| Buteo plagiatus | D | R | |
| Buteo platypterus | I | V | |
| Buteo brachyurus | B2 | R | |
| Harpia harpyja | ?C | B3,I | ? |
| Spizaetus tyrannus | P,D | R | |
| Spizaetus ornatus | P,D | R | |
| Spizaetus melanoleucus | B2 | ?,r | |
| STRIGIFORMES | |||
| TYTONIDAE | |||
| Tyto alba | A | R | |
| STRIGIDAE | |||
| Megascops guatemalae | A | R | |
| Lophostrix cristata | A | ?,r | |
| Bubo virginianus | B4 | RL | |
| Glaucidium griseiceps | B1 | RL | |
| Glaucidium brasilianum | B3 | R | |
| Ciccaba virgata | A | R | |
| Ciccaba nigrolineata | A | R | |
| TROGONIFORMES | |||
| TROGONIDAE | |||
| Trogon massena | P,A,D | R | |
| Trogon melanocephalus | P,A,D | R | |
| Trogon caligatus | P | R | |
| Trogon collaris | P,A,D | R | |
| CORACIIFORMES | |||
| MOMOTIDAE | |||
| Hylomanes momotula | P,R,A | R | |
| Momotus lessonii | P,A | R | |
| Electron carinatum | ?B6 | ?,r | |
| ALCEDINIDAE | |||
| Megaceryle torquata | C | R | |
| Megaceryle alcyon | B2 | V | |
| Chloroceryle amazona | B3 | R | |
| Chloroceryle americana | C | R | |
| Chloroceryle aenea | R | R | |
| PICIFORMES | |||
| BUCCONIDAE | |||
| Notharchus hyperrhynchus | P,D | R | |
| Malacoptila panamensis | P,R | R | |
| GALBULIDAE | |||
| Galbula ruficauda | P,A | R | |
| RAMPHASTIDAE | |||
| Aulacorhynchus prasinus | I | R | |
| Pteroglossus torquatus | P,R,A,D | R | |
| Ramphastos sulfuratus | P,D | R | |
| PICIDAE | |||
| Melanerpes pucherani | C | R | |
| Melanerpes aurifrons | P,D | R | |
| Picoides scalaris | B4 | RL | |
| Picoides fumigatus | P,R,D | R | |
| Colaptes rubiginosus | C | R | |
| Celeus castaneus | P | R | |
| Dryocopus lineatus | P | R | |
| Campephilus guatemalensis | P,D | R | |
| FALCONIFORMES | |||
| FALCONIDAE | |||
| Herpetotheres cachinnans | P,D | R | |
| Micrastur ruficollis | P,R,A,D | R | |
| Micrastur semitorquatus | P,A,D | R | |
| Caracara cheriway | I | V | |
| Falco sparverius | B2 | V | |
| Falco columbarius | B4 | VI,T | |
| Falco femoralis | ?C,B2 | ? | |
| Falco rufigularis | P,D | R | |
| Falco deiroleucus | B3 | ?,r | |
| Falco peregrinus | D | T | |
| PSITTACIFORMES | |||
| PSITTACIDAE | |||
| Eupsittula nana | P,D | R | |
| Ara macao | P | R | |
| Pyrilia haematotis | P,D | R | |
| Pionus senilis | P,A,D | R | |
| Amazona albifrons | P | R | |
| Amazona autumnalis | P | R | |
| Amazona farinosa | P | R | |
| PASSERIFORMES | |||
| THAMNOPHILIDAE | |||
| Taraba major | B2 | R | |
| Thamnophilus doliatus | P | R | |
| Dysithamnus mentalis | P,R | R | |
| Microrhopias quixensis | P,R | R | |
| Cercomacroides tyrannina | P,R | R | |
| Gymnocichla nudiceps | B3 | ? | |
| GRALLARIIDAE | |||
| Grallaria guatimalensis | B3 | ?,r | |
| FORMICARIIDAE | |||
| Formicarius analis | P,R,A | R | |
| FURNARIIDAE | |||
| Sclerurus guatemalensis | P,R,A | R | |
| Sittasomus griseicapillus | P,R | R | |
| Dendrocincla homochroa | P,R | R | |
| Dendrocincla anabatina | P,R,A | R | |
| Glyphorynchus spirurus | P,R | R | |
| Dendrocolaptes sanctithomae | P,R | R | |
| Xiphocolaptes promeropirhynchus | B2 | ? | |
| Xiphorhynchus flavigaster | P,R,A | R | |
| Lepidocolaptes souleyetii | P,A | R | |
| Xenops minutus | P,R | R | |
| Automolus ochrolaemus | P,R,A,D | R | |
| Synallaxis erythrothorax | B1 | R | |
| TYRANNIDAE | |||
| Ornithion semiflavum | C | R | |
| Camptostoma imberbe | B1 | R | |
| Myiopagis viridicata | R | R | |
| Mionectes oleagineus | P,R,D | R | |
| Leptopogon amaurocephalus | R | R | |
| Zimmerius vilissimus | B4 | RL | |
| Oncostoma cinereigulare | B2 | R | |
| Poecilotriccus sylvia | B1 | R | |
| Todirostrum cinereum | C | R | |
| Rhynchocyclus brevirostris | R | R | |
| Tolmomyias sulphurescens | R | R | |
| Platyrinchus cancrominus | P,R | R | |
| Onychorhynchus coronatus | R | R | |
| Terenotriccus erythrurus | R | R | |
| Myiobius sulphureipygius | P,R | R | |
| Contopus virens | B2 | T | |
| Contopus cinereus | R | R | |
| Empidonax flaviventris | B3 | V | |
| Empidonax virescens | B3 | T | |
| Empidonax traillii | B3 | V | |
| Empidonax minimus | B3 | V | |
| Pyrocephalus rubinus | C | R | |
| Attila spadiceus | P,R,A,D | R | |
| Rhytipterna holerythra | P,R,D | R | |
| Myiarchus tuberculifer | P,R,D | R | |
| Myiarchus crinitus | B2 | V | |
| Myiarchus tyrannulus | P,R,D | R | |
| Pitangus sulphuratus | P,D | R | |
| Megarynchus pitangua | B2 | R | |
| Myiozetetes similis | C | R | |
| Myiodynastes luteiventris | D | VR | |
| Legatus leucophaius | B3 | VR | |
| Tyrannus melancholicus | P | R | |
| Tyrannus couchii | B2 | R | |
| Tyrannus savana | C | R | |
| TITYRIDAE | |||
| Schiffornis veraepacis | P,R | R | |
| Tityra semifasciata | P,D | R | |
| Tityra inquisitor | B2 | R | |
| Pachyramphus cinnamomeus | P,D,B1 | B3,I | ?,r |
| Pachyramphus polychopterus | I | ? | |
| Pachyramphus major | C | R | |
| Pachyramphus aglaiae | B1,B2 | R | |
| COTINGIDAE | |||
| Cotinga amabilis | D | R | |
| Lipaugus unirufus | B3 | R | |
| PIPRIDAE | |||
| Manacus candei | P,R | R | |
| Ceratopipra mentalis | P,R | R | |
| LANIIDAE | |||
| Lanius ludovicianus | B3 | ? | |
| VIREONIDAE | |||
| Vireolanius pulchellus | P,A,D | R | |
| Tunchiornis ochraceiceps | P,R | R | |
| Pachysylvia decurtata | P,R,A,D | R | |
| Vireo griseus | B1,B2 | V | |
| Vireo flavifrons | B2 | V | |
| Vireo solitarius | B3 | ? | |
| Vireo philadelphicus | B3 | V | |
| Vireo gilvus | B4 | VI | |
| Vireo olivaceus | P,A,D | T | |
| Vireo flavoviridis | B3 | VR | |
| CORVIDAE | |||
| Psilorhinus morio | P,A,D | R | |
| Cyanocorax yncas | B3 | R | |
| HIRUNDINIDAE | |||
| Progne sinaloae | ?B2 | ? | |
| Progne chalybea | I | VR | |
| Tachycineta bicolor | I | V | |
| Tachycineta albilinea | C | R | |
| Stelgidopteryx serripennis | C | R | |
| Petrochelidon pyrrhonota | C | T | |
| Hirundo rustica | B2 | V | |
| TROGLODYTIDAE | |||
| Microcerculus philomela | B4 | RL | |
| Troglodytes aedon | I | R | |
| Thryothorus ludovicianus | B3 | ?,r | |
| Campylorhynchus zonatus | I | ?,r | |
| Pheugopedius maculipectus | P,R,A | R | |
| Uropsila leucogastra | P,R | R | |
| Henicorhina leucosticta | P,R | R | |
| POLIOPTILIDAE | |||
| Ramphocaenus melanurus | P,R,A | R | |
| Polioptila caerulea | B2 | V | |
| Polioptila plumbea | P,D | R | |
| TURDIDAE | |||
| Catharus mexicanus | B4 | RL | |
| Catharus ustulatus | P,R | T,V | |
| Hylocichla mustelina | P,R,A | V | |
| Turdus grayi | C | R | |
| Turdus assimilis | R | R | |
| MIMIDAE | |||
| Dumetella carolinensis | P,R | V | |
| PASSERIDAE | |||
| Passer domesticus | B4 | RL | |
| FRINGILLIDAE | |||
| Euphonia affinis | C | R | |
| Euphonia hirundinacea | P,R,D | R | |
| Euphonia gouldi | R | R | |
| Spinus psaltria | B4 | Va | |
| PASSERELLIDAE | |||
| Arremon aurantiirostris | P,R | R | |
| Arremonops chloronotus | P,R | R | |
| Melospiza lincolnii | B3 | ? | |
| ICTERIIDAE | |||
| Icteria virens | R | V | |
| ICTERIDAE | |||
| Sturnella magna | C | R | |
| Amblycercus holosericeus | C | R | |
| Psarocolius wagleri | B3 | R | |
| Psarocolius montezuma | P,A,D | R | |
| Icterus prosthemelas | D | R | |
| Icterus spurius | B1,B2 | V | |
| Icterus cucullatus | B3 | Va | |
| Icterus chrysater | B4 | Va | |
| Icterus mesomelas | C | R | |
| Icterus bullockii | B4 | VI | |
| Icterus pectoralis | B3 | ? | |
| Icterus gularis | B3 | RL | |
| Icterus galbula | D | V | |
| Agelaius phoeniceus | C | R | |
| Molothrus aeneus | I | R | |
| Molothrus oryzivorus | I | ?,r | |
| Dives dives | C | R | |
| Quiscalus mexicanus | C | R | |
| PARULIDAE | |||
| Seiurus aurocapilla | P,R | V | |
| Helmitheros vermivorum | R | V | |
| Parkesia motacilla | B2 | V | |
| Parkesia noveboracensis | P,R | V | |
| Vermivora chrysoptera | B1 | V | |
| Vermivora cyanoptera | R | V | |
| Mniotilta varia | P,R | V | |
| Protonotaria citrea | C | V | |
| Oreothlypis peregrina | I | V | |
| Oreothlypis ruficapilla | B4 | VI | |
| Geothlypis poliocephala | C | R | |
| Geothlypis tolmiei | B1 | B3 | ? |
| Geothlypis philadelphia | B4 | T | |
| Geothlypis formosa | P,R,A | V | |
| Geothlypis trichas | R | V | |
| Setophaga citrina | P,R | V | |
| Setophaga ruticilla | P,R,D | V | |
| Setophaga pitiayumi | B3 | RL | |
| Setophaga magnolia | P,R,D | V | |
| Setophaga castanea | B3 | ?,t | |
| Setophaga petechia | B1,B2 | V | |
| Setophaga pensylvanica | B3 | V | |
| Setophaga caerulescens | B4 | VI | |
| Setophaga virens | B2 | V | |
| Basileuterus culicivorus | P,R,A | R | |
| Cardellina pusilla | C | V | |
| CARDINALIDAE | |||
| Piranga rubra | P,R,D | V | |
| Piranga ludoviciana | B1 | Va | |
| Piranga leucoptera | B4 | RL | |
| Habia rubica | R | R | |
| Habia fuscicauda | P,R,A | R | |
| Caryothraustes poliogaster | P,D | R | |
| Pheucticus chrysopeplus | B3 | RL | |
| Pheucticus ludovicianus | B1,B2 | V | |
| Granatellus sallaei | B1 | R | |
| Amaurospiza concolor | B3 | ? | |
| Cyanocompsa cyanoides | P,R | R | |
| Cyanocompsa parellina | P,R | R | |
| Passerina cyanea | R | V | |
| Passerina ciris | B1 | V | |
| THRAUPIDAE | |||
| Thraupis episcopus | C | R | |
| Thraupis abbas | P | R | |
| Tangara larvata | P,D | R | |
| Chlorophanes spiza | D | R | |
| Volatinia jacarina | B1,B2 | R | |
| Eucometis penicillata | R | R | |
| Lanio aurantius | P,R,A,D | R | |
| Ramphocelus sanguinolentus | C | R | |
| Ramphocelus passerinii | C | R | |
| Cyanerpes cyaneus | P,D | R | |
| Coereba flaveola | B1 | R | |
| Tiaris olivaceus | B2 | R | |
| Sporophila funerea | I | R | |
| Sporophila corvina | C | R | |
| Sporophila torqueola | P,R | R | |
| Saltator atriceps | C | R | |
| Saltator maximus | B1 | R | |
| Saltator coerulescens | B1,B2 | R |
1 Nomenclatura taxonómica según AOU 2017: http://checklist.aou.org/taxa/
2 Registradas por puntos de conteo (P), redes neblineras (R), conteos antes del amanecer (A), en el dosel (D) y observaciones casuales (C). Registro bibliográfico: Morales, 2001 (B1), Asturias, 2013 (B2), Soto, 2003 (B5), Eisermann y Avendaño, 2006 (B7). Registro de eBird (I). Posible avistamiento (?C, ?B2).
3 Registro por: Puebla-Olivares et al., 2002 (B3), Fagan y Komar, 2016 (B4), Miller y Miller, 1996 (?B6), eBird (I).
4 Según Fagan y Komar (2016): residente permanente (R), residente local (RL), visitante no reproductivo (V), visitante reproductivo (VR), visitante irregular (VI), transitorio (T), vagante (Va), estado incierto par el PNSL (?). Según Howell y Webb (1995): residente (r), transitorio (t).

